过去十多年,抗血小板药物替格瑞洛已成为治疗急性冠状动脉综合征的可靠药物,并被全球心血管指南推荐使用。但自2011年获得美国FDA批准以来,一直有研究者怀疑该药物相对于更便宜的P2Y12 抑制剂(如氯吡格雷和普拉格雷)是否存在明显优势。
将替格瑞洛推向上市的3期试验显示,替格瑞洛疗效优于氯吡格雷,但上市后研究却一再报告令人失望的结果,显示出与氯吡格雷疗效相似,且出血和呼吸困难的发生率增加,这促使人们呼吁重新评估该药物。
随着替格瑞洛仿制药物即将在美国上市,BMJ重新审视了相关证据。其中,替格瑞洛的主要临床试验PLATO是长期激烈争论的焦点。
BMJ链接:https://www.bmj.com/content/387/bmj.q2550
PLATO研究
2000年代中后期,阿斯利康公司开发替格瑞洛时,需要证明其优于氯吡格雷,后者当时是全球最畅销的处方药之一。PLATO研究是一项在43个国家/地区进行的随机试验,共有18,624 名患者参与。PLATO研究者在2009年的《新英格兰医学杂志》 ( NEJM ) 上发文称,治疗12个月后,与氯吡格雷组相比,替格瑞洛组患者的主要终点(血管性死亡、心肌梗死或卒中)风险从11.7%降至 9.8%,相对风险降低了16%[1]。
但是首次申请FDA批准却失败了。因为亚组分析发现,在美国患者中,替格瑞洛组的预后比氯吡格雷组患者更差——主要终点风险增加27%[2]。

研究者解释称,结局不佳是由于阿司匹林剂量异常高所致(这种剂量几乎只在美国出现过),但FDA专家并不认可。
FDA的外部顾问也同样感到担忧。在2010年FDA 组织的一次讨论会上,顾问委员会成员以7:1的投票结果建议批准替格瑞洛,但敦促FDA要求企业在美国人群中进行上市后试验。FDA并没有采纳该建议要求进行此类研究,而是让企业重新提交申请,并对阿司匹林假说进行更详细的分析。
尽管有疑虑,FDA仍批准了替格瑞洛
Thomas Marciniak是一名FDA医疗官员,素以严格审查制药公司申请而闻名,被指派评估阿斯利康重新提交的申请。几个月后,Marciniak发现自己不仅不相信阿司匹林假说,还对PLATO试验数据的可靠性深感担忧。
他在2011年一份长达47页的审查记录中表示,“我认为,PLATO研究的数据质量存在很多问题,至少美国患者的结果能代表替格瑞洛的疗效,即替格瑞洛的疗效和安全性不如氯吡格雷”。并建议不予批准[3]。
FDA领导层没有采纳Marciniak的意见。无论美国患者的结果是偶然的,还是阿司匹林剂量差异导致的,一位高级机构管理人员认为“替格瑞洛应该获得批准”。
加州大学旧金山分校临床医学教授、P2Y12抑制剂临床价值专家Lloyd Klein告诉《BMJ》:“当时人们认为,阿司匹林剂量问题是药企争取FDA批准的一种手段,因为他们意识到美国的结果数据与欧洲各中心不同。但当时没有前瞻性试验来检验这一假设是否准确。”
争议愈演愈烈
替格瑞洛的批准引发了一些人的持续批评,认为PLATO试验结果不可信。批评人士表示,替格瑞洛在美国患者中失败了,而美国是唯一一个试验中心不会受申办方监控的患者高招募国家。
该试验的执行委员会联合主席撰写了数10篇为PLATO研究辩护的回应。他们指责批评者“学术造假”——断章取义、自我引用、“无视传统统计概率概念”,并质疑他们的动机。
这件事在多家心脏病学杂志上都有报道,至今仍在继续。争议在2013年达到顶峰,当时美国司法部于10月对PLATO展开正式调查,随后一个月,欧洲药品管理局也提出质询。
美国司法部的调查由约翰霍普金斯大学的Victor Serebruany指导,他可以说是 PLATO研究最早也是最执着的批评者,FDA在批准前的评审过程中向他寻求过建议。Serebruany最初对试验结果印象深刻,但在注意到数据中的不一致和异常后则转变为怀疑。2012年9月,他以政府的名义对该药企提起诉讼,指控其“向美国提交了虚假和欺诈性数据”。
但司法部于2014年8月终止了调查,PLATO的研究者则表示自己得到了“平反”:“终止调查的决定应该会消除人们对试验结果可靠性的任何疑虑。”司法部虽然终止了调查,但在一份法庭文件中表明,美国政府“保留重新考虑其决定的权利”。
在司法部调查后的几年,大量观察性研究和随机试验未能复制PLATO试验的结果,导致一些心脏病专家对替格瑞洛在临床实践中的作用提出质疑。密歇根大学内科学教授Eric Bates是美国心脏病学指南的合著者(该指南推荐使用替格瑞洛),他公开呼吁重新评估替格瑞洛。
Bates在接受《BMJ》采访时表示:“我越来越担心,为什么一次又一次的试验结果都不是阳性的”。例如,在一项主要针对日本患者的试验中,替格瑞洛患者的表现比氯吡格雷患者更差,9.0%的患者发生了主要终点,而氯吡格雷患者为6.3%[4]。
重新审视PLATO研究
一些人指出了更令人担忧的可能:PLATO研究的结果从一开始就不可信。这些批评者认为,美国的数据并非异常,实际上比其他国家更可靠。
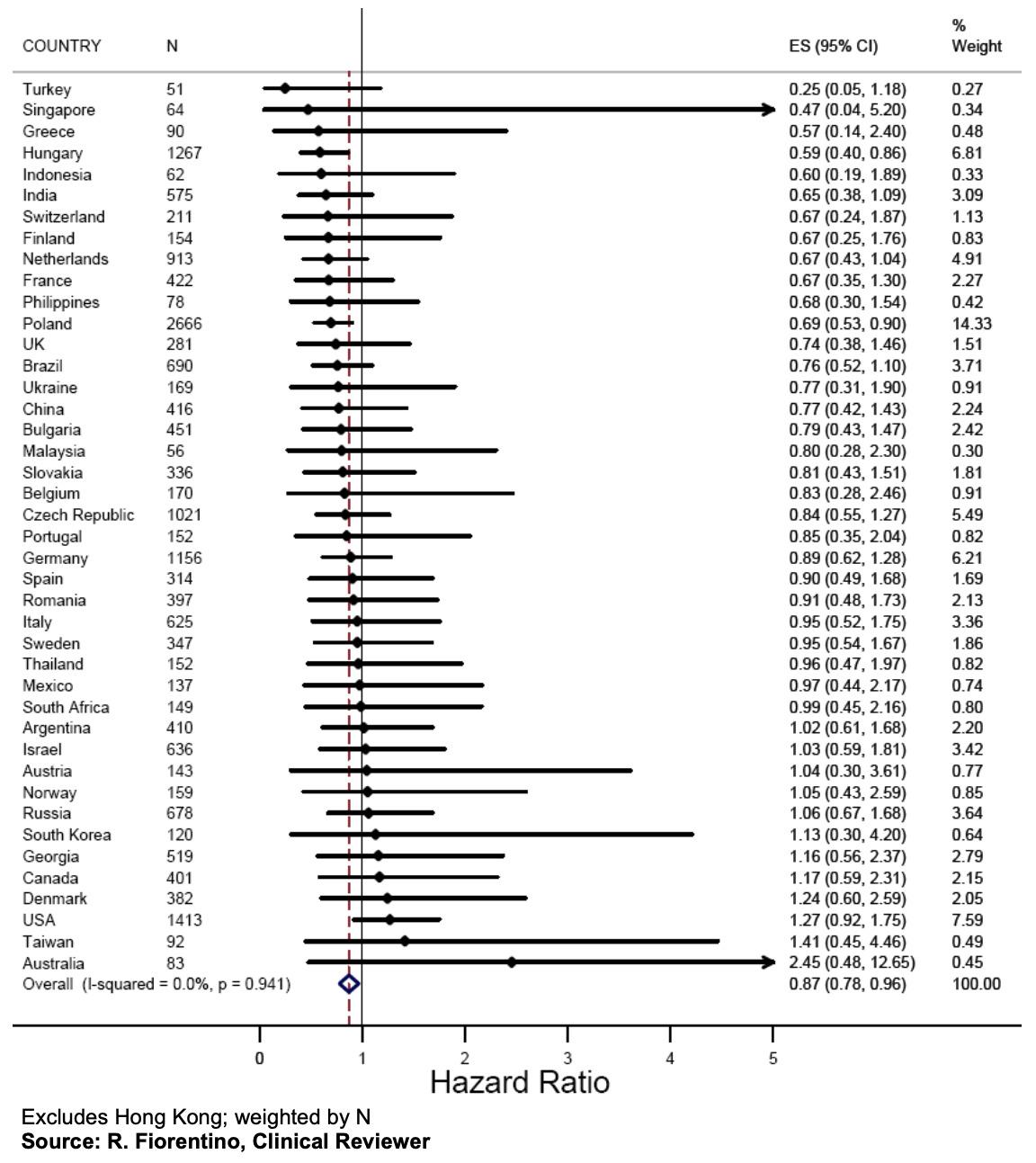
一位来自东欧的PLATO研究中心研究者在接受《BMJ》采访时表示,在看到格鲁吉亚和俄罗斯以及匈牙利和波兰之间的结果大相径庭后,他对整体结果产生了怀疑。在格鲁吉亚和俄罗斯,结果在数字上有利于氯吡格雷。在匈牙利和波兰,这两个国家均由药企监测,替格瑞洛相比氯吡格雷的益处非常显著。
PLATO研究领导层试图驳斥这一论点,称“两位资深统计学家”在分析中已经解决了这个问题。研究联合主席Wallentin和Harrington写道:“虽然不可能从统计分析中得出确切的结论,但没有理由怀疑监测机构对研究结果有影响。”[5]
然而,这篇统计文章的作者并没有进行最直接的分析:CRO监测的研究中心与申办方监测的研究中心患者的主要终点进行比较。
《BMJ》还发现,撰写该分析报告的两位“资深学术统计学家”之一——论文的主要作者Kevin Carroll是阿斯利康的前首席统计学家,曾在该公司工作了20多年。Carroll在FDA 2010年的咨询委员会会议上代表阿斯利康介绍了PLATO研究结果。该论文将Carroll列为“独立统计顾问”,并在他离开阿斯利康的同一年提交发表,但未披露他以前的工作经历。
终点事件裁决的问题
评估药物的疗效,依赖于准确统计符合主要终点定义的事件,在PLATO的案例中,主要终点是血管原因死亡(包括致死性出血)、心肌梗死或卒中。一个由51名成员组成的独立中央裁定委员会对治疗分组不知情,审查了超过10,000起事件。
但有人指控PLATO存在偏倚。Victor Serebruany在其2012年提交的投诉中,指控 PLATO的裁定人员在氯吡格雷组增加了45个心梗事件,而替格瑞洛组则没有增加任何心梗事件。
《BMJ》证实了 Serebruany 的数据。FDA记录显示,根据现场报告,使用替格瑞洛的患者有504人发生心肌梗死,而氯吡格雷组有548人。裁定后,氯吡格雷组的数量增加到 593人。
《BMJ》使用Serebruany首先从FDA获得的试验数据集还发现,裁定委员会在20 个死亡类别判定中存在“重大”分歧,最终无法解决,存在不平衡:17个属于氯吡格雷组,而只有3个属于替格瑞洛组。这种差异引发了人们对揭盲的质疑。
对死亡记录准确性的质疑
当PLATO研究结果首次发表时,人们对替格瑞洛显著的死亡率优势感到震惊。FDA的咨询委员会会议记录显示了这些数据的说服力:至少有两名顾问表示,他们投票批准药物上市是因为死亡率优势。
Serebruany最初也对绝对死亡率的降低感到振奋。作为血小板专家,Serebruany努力解释观察到的益处,他在 2010 年写道,“声称预期就会有如此显著的结果,明显与事实不符”,并指出2期试验的死亡率数据“实际上氯吡格雷的效果更好”。
随着Serebruany最初的乐观态度转变为对试验数据的深深怀疑,他开始联系世界各地的PLATO中心研究者,请求他们协助核实死亡数据。许多人都给予了合作——有些国家,例如墨西哥和加拿大,甚至分享了原始试验文件。但记录并不总是相符。
在东南亚的一个研究中心,一名 PLATO 研究人员在一封电子邮件中写信给 Serebruany,《BMJ》看到了这封电子邮件,信中说:“我们的患者没有死亡,这点几乎是肯定的”。但根据提交给FDA并经《BMJ》审查的数据,该研究中心发生了四例死亡事件(三例发生在氯吡格雷组),这引发了人们对向 FDA 报告的准确性的质疑。《BMJ》还发现,研究中心层面的记录显示患者死亡日期与FDA数据集中的日期不符。
在加拿大,《BMJ》采访了蒙特利尔大学医学教授 Jean-François Tanguay。他未参与 PLATO临床试验,但他表示提交给FDA的报告内容不准确。《BMJ》看到了 Tanguay 获得的试验记录,其中描述了一名 PLATO 患者的死亡“明显是血管性死亡”。但根据阿斯利康提供给 FDA 的数据库,研究人员将其归类为癌症死亡。Tanguay 表示,这并不像晚期癌症死亡。他表示,研究人员将患者死亡归类为癌症死亡的说法“相当牵强”。
《BMJ》的分析还发现,PLATO的里程碑研究论文存在遗漏。这篇发表在《NEJM》的论文以意向性治疗分析的形式报道,称所有随机化患者中因全因死亡的病例总数为 905 例[1]。然而,一份公司内部报告指出,此时已有983名患者死亡。虽然有33例死亡发生在随访期后,但《NEJM》的统计数字仍然遗漏了45例“在撤回同意后发现的死亡病例”。《BMJ》获得了一些未在《NEJM》上报告死亡情况的患者记录(见下表),并要求《NEJM》作出回应。
表1. NEJM分析中包括和排除的死亡病例
《NEJM》并未对此提出异议,但表示不确定是否要发表更正。NEJM主编 Eric Rubin 援引了国际医学期刊编辑委员会 (ICMJE) 的新指南,告诉《BMJ》,“对于早期的论文手稿,除非对临床实践有影响,否则不一定要更正”,并表示“更正这篇15年前的文章似乎不会产生任何影响”。(但目前的 ICMJE 指南指出:“需要更正事实错误”)。Rubin 补充道,“事实上,FDA 使用你们[BMJ]提供的数据批准了该药物。”
Rubin表示他会尝试联系作者。“但是,如果无法联系到作者或者他们无法访问数据,我们很可能不会进行更正。我们已经写信给PLATO试验联合主席并等待回复,然后将决定如何推进。”
后续
PLATO试验发表15 年后,Serebruany持续发表批评文章。自2016年以来,其中许多文章都是由Marciniak合著的,Marciniak现已从FDA退休。然而,PLATO的研究人员似乎基本上已经停止回应。
在接受《BMJ》采访时,Serebruany 表示,他对科学手段能够解决 PLATO 数据完整性问题不抱太大希望。在他看来,唯一的出路是司法部重新介入。
参考文献:
1. N Engl J Med. 2009;361(11):1045-57.
2.http://web.archive.org/web/20170114003058/http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/CardiovascularandRenalDrugsAdvisoryCommittee/UCM221383.pdf
3.www.accessdata.fda.gov/drugsatfda_docs/nda/2011/022433Orig1s000MedR.pdf#page=12
4. Circ J. 2015;79(11):2452-2460.
5. Int J Cardiol. 2014 ;170(3):e59-62.
