近几年,很多药企开始重视罕见病领域的布局,在今年上半年获批的药物中,Skyclarys、Daubue和Joenja等多款药打破了其治疗领域“无药可用,无药可医”的困局,让众多的罕见病患者有了希望。
在过去十年中,中国也出台了促进罕见病药物研发的政策。国家食品药品监管总局2017年发布并实施《关于鼓励药品创新实行优先审评审批的意见》明确了包括罕见病药物在内的18类优先审评审批事项,加快了罕见病药物和其他临床急需制剂的审批。
2019年《中华人民共和国药品管理法》和 2020 年《药品注册管理办法》强化了这一政策。最近,国家药监局于 2022 年发布了《罕见病药物临床研究与开发指导原则》,对罕见病药物的试验设计提出了详细建议。对此,清华大学医学院和北京协和医院相关研究人员分析了过去十年中国和全球罕见病治疗药物的临床前和临床开发管线以及2022年底的状况。
研发格局
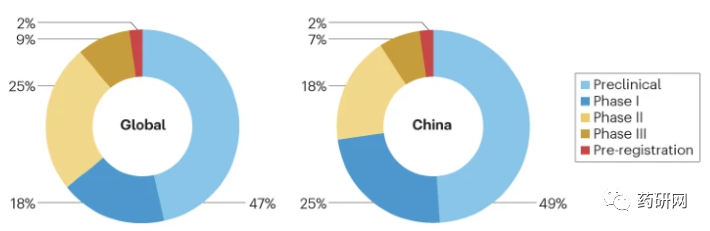
截至 2022 年底,中国有近一半(49%)在研罕见病药物处于临床前阶段。临床药物中,206 种(25%)药物已进入 I 期,152 种(18%)药物已进入 II 期,56 种(7%)药物已进入 III 期,14 种(2%)药物处于注册前阶段。
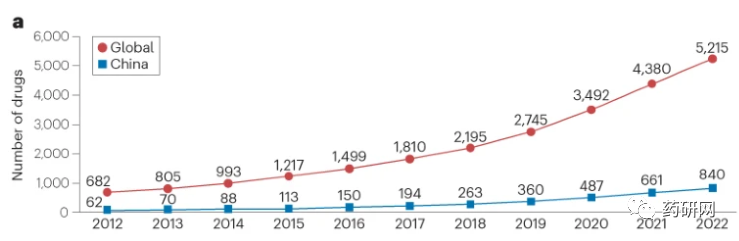
就全球来说,共有 5215 种罕见病药物正在研发中,阶段分布与国内相近。
相较全球的24%增长率,中国近五年来罕见病管线数量以34%的年增长率大幅增长,增长时间与2017年国内推行的医疗卫生体会改革相吻合。
治疗领域
肿瘤在罕见病领域仍是全球最关注的治疗领域,占全球罕见病管线的43%,占国内管线71%。非霍奇金淋巴瘤、胰腺癌、骨髓瘤、急性骨髓性白血病和卵巢癌在全球和国内的研发占比都较高。
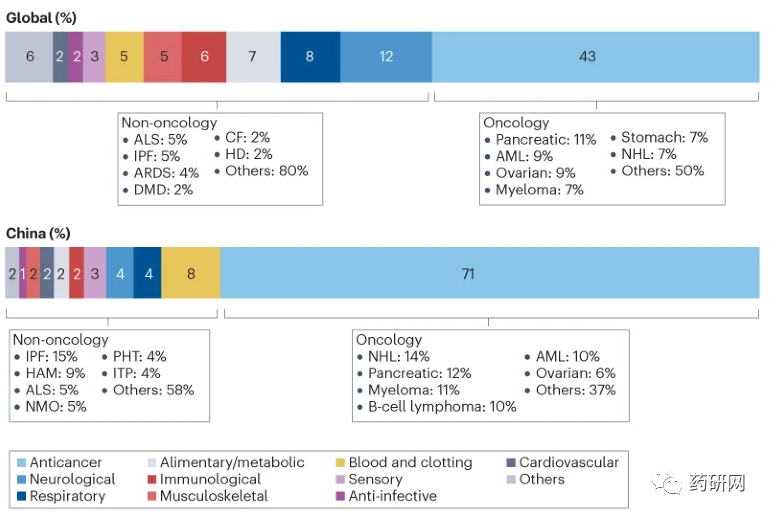
全球其他治疗领域包括神经系统疾病(12%)、呼吸系统疾病(8%)、消化系统/代谢性疾病(7%)和免疫系统疾病(6%)。中国的重点有所不同。在中国开发的所有药物中,只有 4% 用于治疗神经系统疾病,2% 用于治疗消化系统/代谢性疾病,这些领域可能存在大量未满足的医疗需求。
药物和主办方类型
在全球范围内,生物制剂几乎占罕见病制剂总体管线的一半(49%),其中前三位为蛋白质制剂(20%)、细胞制剂(16%)和核酸制剂(9%)。
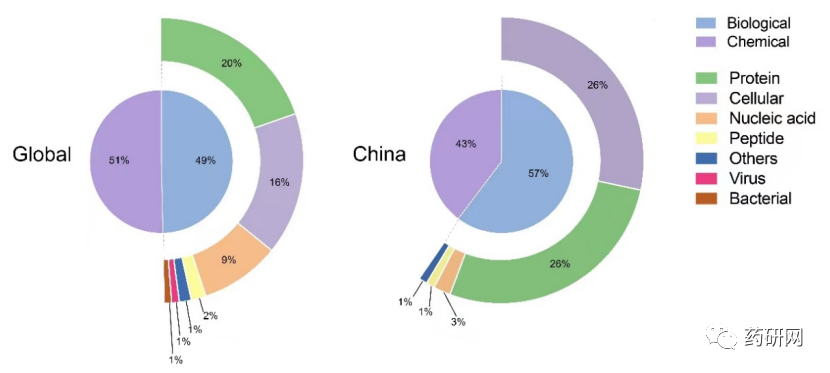
在中国,生物制剂以细胞制剂(26%)和蛋白制剂(26%)两大管线为主,其次是核酸药物。鉴于核酸平台在全球范围内取得的持续进展及其与罕见病的高度相关性,基于此类平台的疗法可能是中国罕见病药物管线中一个有希望的增长机会。
学术机构参与主办了全球 15% 和中国 25% 的制剂开发。其中化学制剂占全球的 47%,其次是细胞制剂和蛋白质制剂。相比之下,在中国,学术机构参与主办的药物中以细胞疗法为主(48%),其次是化学制剂和蛋白质制剂(18%)。
随着细胞疗法等新一代技术在罕见病研发中占据重要地位,而且中国从事此类疗法研究的学术机构已与行业赞助商建立了合作关系,从而在研发早期阶段就建立了合作伙伴关系,这些技术也可能成为中国罕见病药物管线的一个快速增长领域。
就国内而言,中国对罕见病药物开发的支持政策促进了该领域的医疗创新,这从过去五年中国罕见病管线中药物数量的快速增长中可见一斑。与全球管线相比,中国在治疗领域、药物类型和学术机构的转化研究方面各有侧重。随着中国政府在该领域的激励措施和监管改革的持续推进,罕见病药物研发的持续增长可期。
