2011年,NEJM曾总结过ClinicalTrials.gov上近2200项临床试验结果的特征[1],近日,NEJM刊登了一篇文章,对提交到ClinicalTrials.gov上的临床试验的研究结果再次进行了总结。
ClinicalTrials.gov是由美国卫生研究所(NIH)下属美国国立医学图书馆(NLM)与美国食品药品监督管理局(FDA)运行的临床试验资料库,是目前国际上最重要的临床试验注册机构之一,2008年9月,ClinicalTrials.gov数据库扩大到包含研究结果。
此数据库包含研究结果的摘要信息,不涉及讨论或结论部分。FDAAA(食品和药品监督管理局现代化法案),要求将结果报告给ClinicalTrials.gov,以解决临床试验结果未公开、结果报告不完整和不良事件的相关问题。
截至2019年5月,研究结果数据库已包含36,000多项研究的数据。本文总结了当前数据库的要求,ClinicalTrials上报告的研究结果情况,以及该数据库进一步发展面临的挑战和机遇。
法律、法规、政策要求
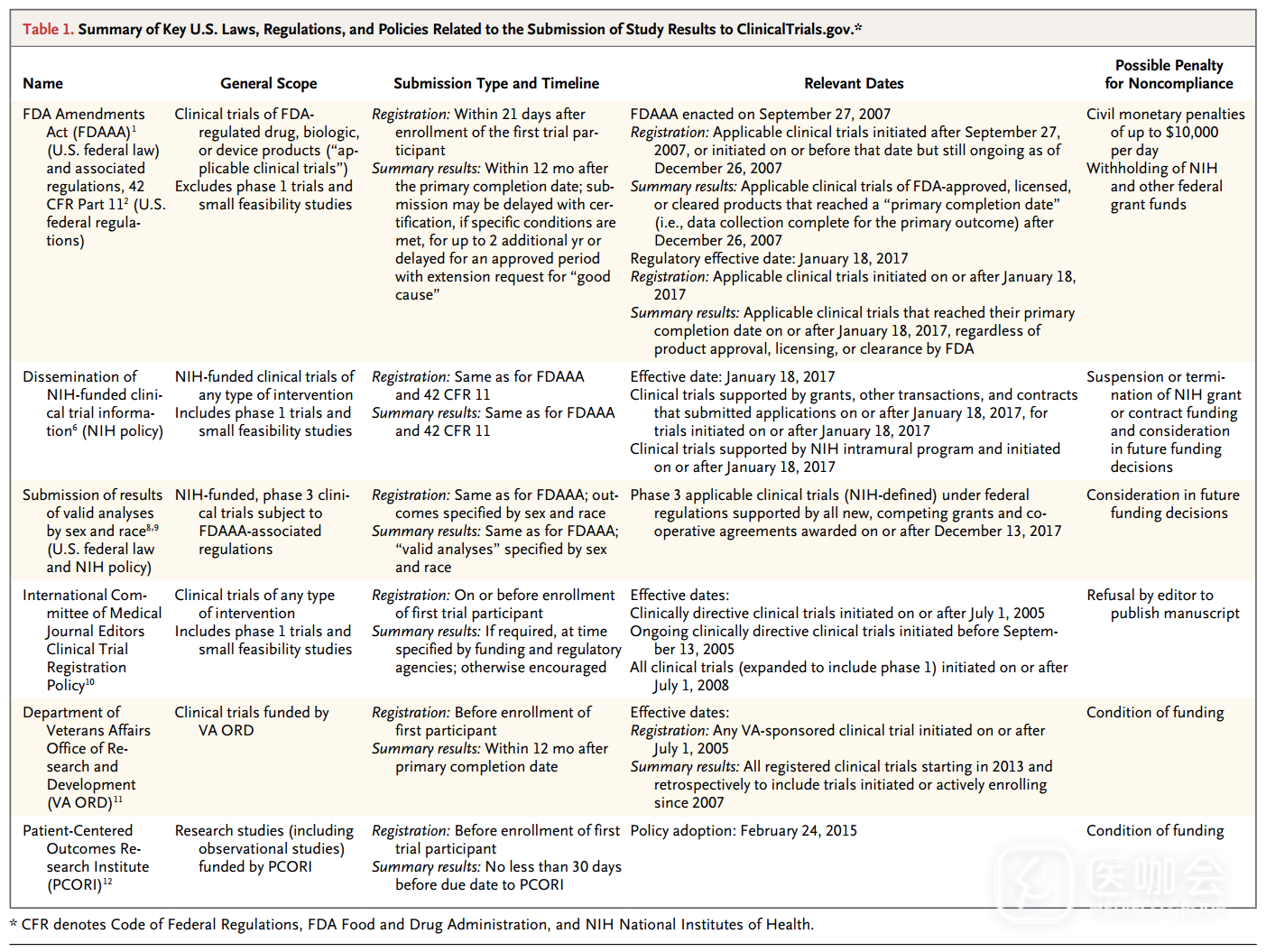
FDAAA法规和一些政策要求或鼓励在ClinicalTrials.gov上报告研究结果(表1)。ClinicalTrials.gov上的信息由临床研究申办方或主要研究者提供和更新。
表1. 将研究结果提交到ClinicalTrials.gov的法律、法规和政策总结
NIH的法规和试验报告政策要求申办方或主要研究者必须在试验主要结果完成后1年内提交结果数据,在某些情况下允许延迟提交结果。
提交的研究结果包含哪些内容
在ClinicalTrials.gov上发布的每项记录均代表一项研究。通常在研究开始时提供的注册信息概述了研究的关键细节和其他信息,这些信息可以跟踪受试者入组和研究进展。研究完成后,可以从以下几个方面(非必须)将结果数据添加到研究记录中:Participant Flow(受试者在研究期间的进展情况),基线特征,结果和统计分析,不良事件和研究文件(研究方案和统计分析计划)(表2)。











确认删除