从研究设计和样本量方面,总结分析中国COVID-19临床研究
前几天,医咖会发布了JAMA子刊的一项研究,该研究分析了674项COVID-19临床试验,发现试验的重复性很高,特别是氯喹试验(详情请查看:JAMA子刊总结分析674项COVID-19临床试验)。该研究集中分析了美国的COVID-19临床试验情况,那么,中国的COVID-19临床研究又有何特点呢?
近期,《Annals of Translational Medicine》刊登了北医三院临床流行病学研究中心的一项研究(陶立元博士和张华博士为第一作者,赵一鸣教授和詹思延教授为通讯作者)[1],从研究方案的科学性和可行性方面,回顾和总结了中国COVID-19临床研究的情况,一起来看下详细内容吧。
原文链接:
http://atm.amegroups.com/article/view/45928/html
2020年3月11日,研究者在世界卫生组织国际临床试验注册平台(WHO ICTRP)和clinicaltrials.gov数据库上检索了COVID-19相关的临床研究,并分析了干预性研究的科学性和可行性。
研究结果
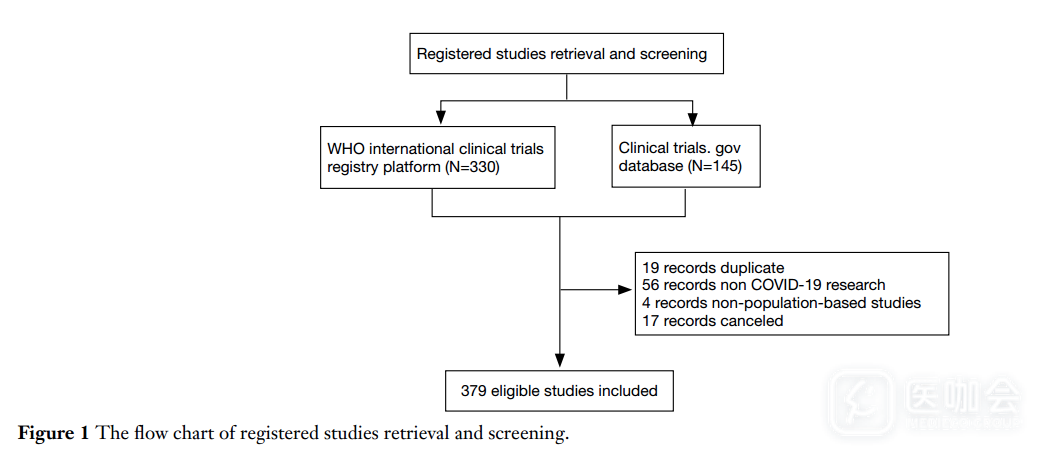
截至2020年3月11日,研究者从ICTRP上检索到了330条结果,从ClinicalTrials.gov上检索到145条结果。合并两个数据集后,排除了重复研究(19项),非冠状病毒研究(56项),非人群研究(4项),已撤回研究(17项,4.3%)后,本研究最终纳入了379项研究(图1)。
图1. 注册研究的筛选流程图
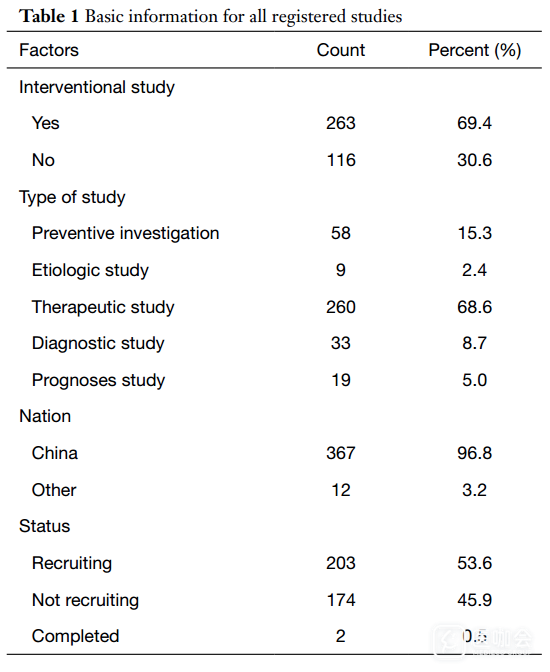
有367项(96.8%)注册研究是由中国研究者主持的。截至2020年3月11日,只有2项(0.5%)研究已完成。
表1. 注册研究的基本信息
研究的注册时间分布
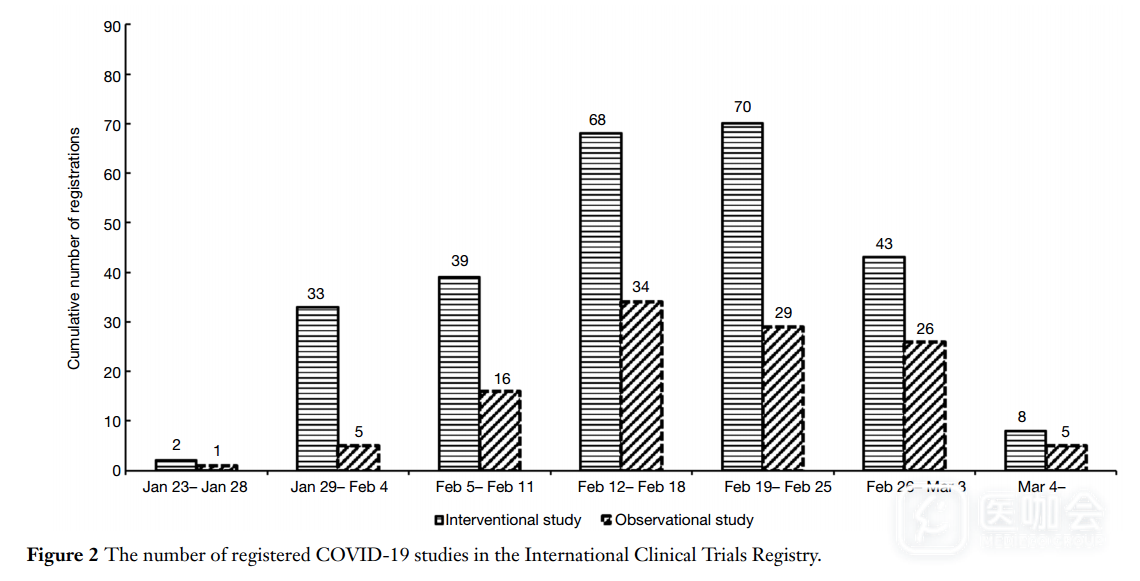
第一项临床研究于1月23日注册,研究类型为随机对照试验(RCT)。这是在确认冠状病毒2周后注册的,当时中国确诊554例病例。考虑到注册审核、研究方案制定和伦理等问题,中国的Covid-19临床研究起步很早,且进展迅速。2020年2月18日和19日,注册的研究最多,每天都有22项研究。具体的研究注册日期分布如图2所示。干预性研究和观察性研究的注册日期趋势相同,但干预性研究的注册数量大于观察性研究(263 vs 116)。
图2. COVID-19临床研究的注册日期分布
中国干预性研究的基本信息
研究选取了在中国进行的干预性研究单独进行了分析,一共有257项研究。其中,治疗性研究占到了91.1%。79.6%的研究获得了伦理审批。近60%的研究纳入了所有类型的患者,约16%的研究纳入一般患者,近20%的研究纳入重症患者。70%的研究的受试者被分为两组,有15项研究分了4组或以上。
研究方案的科学性
在有两组或以上分组的研究中,近90%采用了随机化。近15%的干预性研究在研究设计中使用了盲法。在结局指标方面,一般会推荐1-2个主要结局指标,但35%的研究有2个以上的主要结局指标。结局指标数量最多的一项研究,有37个主要结局指标;还有11项研究的主要结局指标超过10个。80%研究的主要结局指标为客观指标。
研究方案的可行性
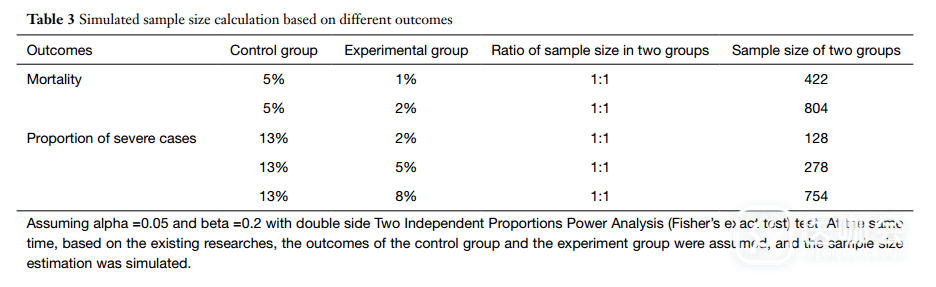
在样本量方面,一半研究的样本量在60-200之间。根据现有的文献数据,估算出以死亡率为结局的研究需要至少422名受试者,以重症患者比例为结局的研究需要至少128名受试者(表3),对应分别只有14项(5.4%)和92项(35.8%)研究满足了样本量需求,也就是说,大多数研究没有满足样本量的要求。研究者计算了整体研究所需的病例,为32333例,约占中国所有确诊病例的40%。
表3. 基于不同结局估算的样本量
总结
在疫情爆发时,中国的科研人员反应迅速,注册了多项COVID-19临床研究,研究设计的质量也较高。不过,也存在一些不足,例如样本量不足、多学科团队间协调差、研究过程质量控制薄弱等。
更多阅读
2020年2月份,多位卫生统计学与流行病学工作者联合在《中华流行病学杂志》发表了一份共识:《关于科学、规范、有序地开展新型冠状病毒肺炎相关临床试验的建议》[2]。
专家们给出了以下6条建议:
1. 研究者需要自律,严谨科学地设计临床试验,避免利益冲突。越是在困难的时候越是要坚守循证医学的底线,一切为患者康复着想,一切为了让疫情得到有效的防控出发。
2. 临床试验必须经过研发单位正常的伦理审查,如果在异地开展临床试验,其方案必须经异地的卫生行政部门审核备案,异地卫生行政部门有监督实施的义务与权力。
3. 临床试验设计必须坚持随机、对照、重复的基本原则,尽量采用客观指标,尽可能使用盲法评价,并遵循临床试验统计学指导原则,避免仓促分析导致错误结论。
4. 在临床试验没有结束时,课题组不应该发布未经审核的研究结果,一是避免对研究结果的解释引入偏倚,二是避免媒体过度炒作影响公众对研究的期待。
5. 此时更需要国家与地方行政部门加强管理,相关政府管理部门应该科学、规范、有序地组织此类研究,呼吁有关部门应该实地现场检查、督导与调研。
6. 治疗新型冠状病毒肺炎药物的疗效应该由权威部门发布,建议媒体谨慎报道基于个案的、缺乏对照的药物疗效。研究者向公众宣称治疗效果时,应同时公布有关研究的设计和相关数据,接受科学界与公众监督。
参考文献来源:
1.http://atm.amegroups.com/article/view/45928/html
2.http://html.rhhz.net/zhlxbx/20200304.htm
扫码关注“医咖会”公众号,及时获取最新重磅研究